Conceptos de número atómico, número de masa, masa atómica e isótopos
Antes de iniciar revisarás el concepto de elemento.
Número atómico y número de masa
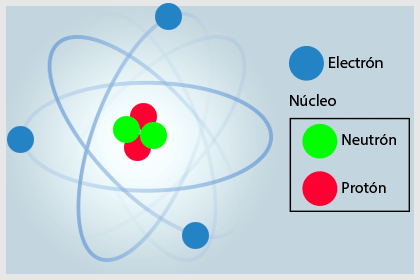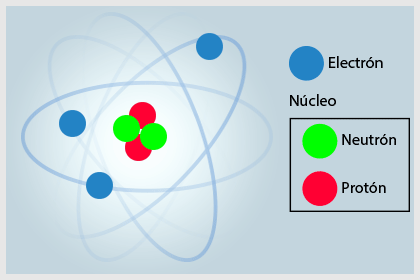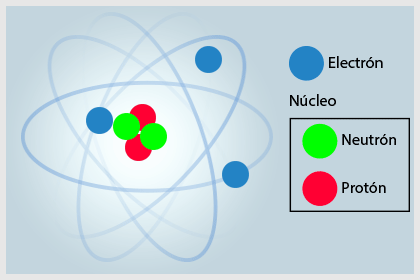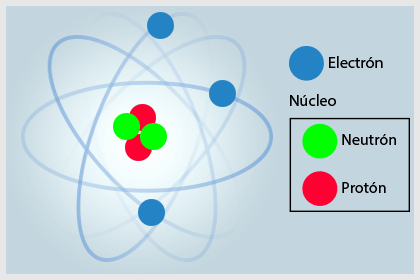
El átomo en conjunto es neutro ya que cada protón en el núcleo está en equilibrio con un electrón en los orbitales. Todos los átomos de un elemento determinado tienen el mismo número de protones en el núcleo y de electrones en los orbitales.
Un elemento se define como una sustancia compuesta por átomos que poseen la misma carga nuclear. La carga nuclear es distinta para cada uno de los elementos, ello da lugar a lo que se ha denominado como número atómico.
El número atómico es el número de protones que se hallan en el núcleo de un átomo y es igual al número de electrones. Este número sirvió para ordenar los elementos en la tabla periódica y se representa con la letra Z. Por encontrarse tanto los protones como los neutrones en el núcleo se les llama nucleones.
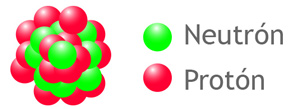
A la suma de neutrones más protones del núcleo se le nombra número de masa y se representa con la letra A; este valor es siempre un número entero, por ejemplo, en el flúor hay 9 p+ y 10 n0, por lo tanto, el número de masa A será 9 + 10 = 19: A = 19, el número de masa del flúor es 19. Si el número de masa A es igual al número de protones más neutrones y el número atómico Z es igual al número de protones, entonces la diferencia de A – Z debe ser igual al número de neutrones que tiene el núcleo.
El uranio tiene número de masa (A) = 238 y su número atómico (Z) es 92, por lo que el número de neutrones en su núcleo será A – Z = n0, es decir, n0 = 238 – 92 = 146, por lo que en el núcleo hay 146 neutrones.
Isótopos
Los isótopos son átomos que tienen el mismo número de protones (igual número atómico) pero distinto número de neutrones, por lo tanto, diferente número de masa, además ocupan el mismo lugar en la tabla periódica de los elementos.

JOLULIPA: Reason&Science (2014) Los Atomos (sic). [Archivo de video]. Recuperado de https://youtu.be/19NOlgO7wC0
Enciclopedia Libre Universal en Español (2011). Tabla periódica de los elementos. Recuperado de http://enciclopedia.us.es/index.php/Tabla_peri%F3dica_de_los_elementos
Los átomos del mismo elemento pueden tener diferente número de neutrones; las diferentes versiones posibles de cada elemento son llamadas isótopos. Por ejemplo, el isótopo más común del hidrógeno no tiene ningún neutrón; también hay un isótopo del hidrógeno llamado deuterio, con un neutrón, y otro nombrado tritio, con dos neutrones.
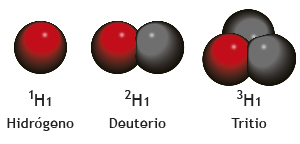
La mayoría de los elementos no existen como un isótopo sencillo sino que son una mezcla de isótopos; por esta razón las masas atómicas son realmente las masas atómicas promedio. Los isótopos ocupan el mismo lugar en la clasificación periódica y pertenecen, por tanto, al mismo elemento.
Los isótopos que tienen menos neutrones son más ligeros y se llaman isótopos ligeros, los que tienen más neutrones pesan más y se llaman isótopos pesados. Para distinguir los isótopos entre sí se escribe el símbolo del elemento y como exponente el número de masa, por ejemplo: hierro-57, uranio-238 y helio-3. En los casos anteriores: 57Fe, 238U y 3He.
El Ca (calcio) tiene varios isótopos, si se quiere encontrar el número de neutrones de alguno de ellos debes saber su número de masa y el número atómico de cada isótopo, por ejemplo:

En la siguiente tabla se dan ejemplos de isótopos del calcio, así como de su vida media (tiempo que tarda en desaparecer la radiación) y el porcentaje de cada uno en la naturaleza.

La unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa de 12 u.m.a.
Esto se debe a que los elementos tienen isótopos y para determinar la masa atómica de un elemento se toman en cuenta los isótopos del elemento y el porcentaje de cada uno de ellos para obtener la masa promedio del elemento, por lo tanto, las masas atómicas no son exactas, por ejemplo:

Entonces, para encontrar la masa atómica del cloro se toma en cuenta el número de masa y el porcentaje de cada uno de los isótopos.

Hasta este momento identificaste lo que es el número de masa, comprendiste que existen los isótopos de los elementos y porqué la masa atómica no es siempre un número entero, todo esto te ayudará para entender el próximo tema.

