Principios relacionados con la distribución electrónica
Existen principios para ordenar los electrones en los distintos orbitales o reempes para que no resulte un caos.
Uno de estos principios, de gran importancia, fue el propuesto por Wolfang Pauli en 1925 donde pone en orden el modelo de la mecánica cuántica, esta regla se conoce como principio de exclusión de Pauli, y dice:
Podrán tener iguales uno de los cuatro números cuánticos o dos o tres, pero nunca podrán tener los cuatro números cuánticos iguales.
Otro principio es el de la regla de Hund o principio de máxima multiplicidad; esta regla se aplica cuando un orbital p, d o f es ocupado por más de un electrón, y dice:
Por ejemplo:
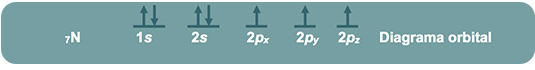
Ningún orbital p puede poseer dos electrones hasta que todos los orbitales p tengan, cuando menos, un electrón.
Principio de edificación progresiva o regla de Aufbau
Al aplicar este principio encontramos el orden de llenado correcto porque la energía del electrón en un orbital determinado se puede representar como la suma del número cuántico n más el número cuántico l. Los electrones ocupan primero los orbitales de menor energía. En el caso de dos orbitales con el mismo valor para n + l se ocupará primero el que tenga menor valor de n.
Observa las siguientes tablas:
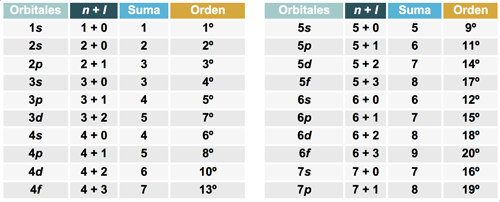
El orden de llenado será:

Al observar el orden de llenado se ve que hay subniveles que traslapan, es decir, subniveles que perteneciendo a un cierto nivel tienen energía comparable a la de un nivel superior (traslapar significa rebasar).
El principio de edificación progresiva se puede enunciar de la siguiente manera:
Una manera de ordenar correctamente los electrones en el átomo es seguir la regla de las diagonales, al hacerlo se observa que se sigue el mismo orden que en el principio de edificación progresiva.

El último electrón que entra a un átomo cuando se efectúa el llenado del mismo, siguiendo los principios establecidos anteriormente, es el electrón diferencial y sirve para distinguir un átomo de todos los demás.
Para escribir la distribución de los electrones en un átomo se utiliza la configuración electrónica, la cual se hace de acuerdo con:
El exponente x representa el número de electrones que hay en el orbital, n es el coeficiente y l es el tipo de orbital. El orden de escritura se encuentra acorde al orden de llenado de orbitales, siguiendo la regla de las diagonales. Ejemplo:
Recuperado de https://phet.colorado.edu/es/simulation/build-an-atom
Como lo comprobaste en la Disposición de los electrones en un átomo, la suma de los exponentes de la configuración se encuentran en el número atómico del elemento, como se muestra en el siguiente ejemplo:

Instituto de Enseñanza Secundaria Alonso Quesada. Recuperado de http://www.iesalonsoquesada.org/inicio/fisica/departafyq/animaciones/celectro.swf
Después de haber hecho la configuración electrónica se puede escribir el diagrama energético, este se hace anotando los orbitales, pero en lugar de escribir el número de electrones en cada uno se usan flechas donde el sentido de ellas representa el espín del electrón.
Ejemplo para el átomo de 11 electrones (Na):
Diagrama energético
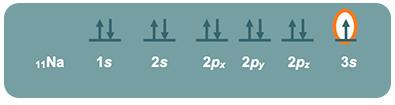
El electrón diferencial es el último que entró en el átomo y se encuentra marcado con un círculo rojo en el diagrama. En este diagrama podemos interpretar los números cuánticos para el electrón diferencial.
Los números cuánticos son:

Para abreviar la escritura de la configuración electrónica o el diagrama energético se utiliza el kernel.
El kernel es un gas noble y se usa porque tiene lleno el orbital externo con ocho electrones. El gas noble que se emplea es el que precede al número de electrones del átomo del que se hará la configuración, se escribirá entre corchetes seguido de los electrones presentes por encima del gas noble.
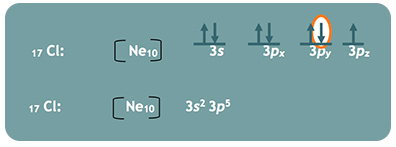
En la configuración se usa el Ne porque es el gas noble que tiene menos e– que el Cl; después de los corchetes sólo escribimos los electrones que faltan para completar los 17 electrones que tiene el átomo.
Chuy, L. (2014). Configuración Electrónica y Números Cuánticos. Recuperado de https://prezi.com/7l9kgdx2z6gq/configuracion-electronica-y-numeros-cuanticos/

