Clasificación de los elementos en función de la configuración electrónica
Como viste en el capítulo anterior, los elementos están colocados en la tabla periódica actual de acuerdo a su número atómico. Es importante recordar que el número atómico (Z) indica la cantidad de protones y electrones que tiene cada elemento, por lo que partir de él pueden desarrollarse sus respectivas configuraciones electrónicas. En consecuencia, la ubicación de los elementos en la tabla periódica se encuentra relacionada con su configuración electrónica.
Grupos y periodos (o bloques)
En la tabla periódica que se te muestra a continuación (ver Figura 1) podrás observar la configuración electrónica abreviada de cada elemento, en la que se utiliza el kernel del gas noble anterior (Ne, Ar, Kr, etcétera).

Si sigues un periodo (renglón) observarás que los electrones llenan los orbitales de forma ordenada, de acuerdo con el principio de construcción progresiva (regla de Aufbau). Al descender por un grupo (columna) podemos notar que ocupan orbitales de mayores niveles de energía, por lo que el número cuántico principal (n) aumenta, aunque la cantidad de electrones de valencia (de la capa más externa) es igual para todos los elementos de un mismo grupo, de modo que se observan similares arreglos en la configuración electrónica de la capa de valencia.
Por ejemplo, Be y Mg se hallan en el grupo IIA porque sus electrones de la capa de valencia están en orbitales s y son dos
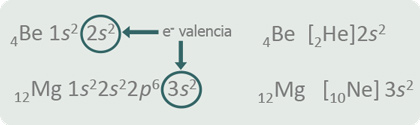
El Be se encuentra en el periodo 2 y el Mg en el 3 porque el orbital 2s, que es el más externo, pertenece al nivel de energía 2 (n=2), en tanto que el orbital 3s es del nivel 3 (n=3).
Así que, con excepción del helio, el número de grupo (en el sistema americano) al cual pertenecen los elementos es igual al número de electrones de su capa de valencia, mientras que el periodo está determinado por el nivel de energía más alto en el que se encuentran los orbitales ocupados por los electrones de valencia.
Los electrones de valencia son aquéllos que se encuentran en orbitales externos a la configuración electrónica del gas noble anterior, la cual siempre terminará con un subnivel np6 (nótese que está lleno, o sea, tiene 6 electrones), con excepción del helio cuya configuración es 1s2.
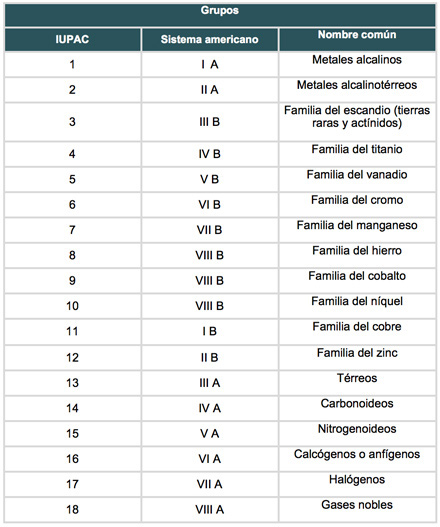
Además, los elementos que forman parte de una misma familia o grupo presentan propiedades similares debido a sus semejantes configuraciones electrónicas. Por dicha razón, los distintos nombres con que se conocen a los dieciocho grupos o familias están relacionados con las propiedades que exhiben.
En la siguiente tabla se enlistan los nombres asignados por la IUPAC, el sistema americano y el nombre común.
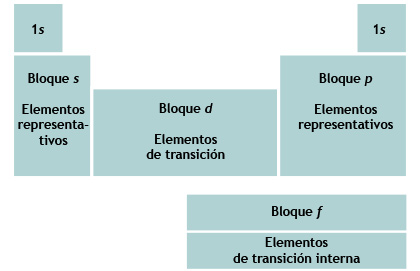
Por otra parte, de acuerdo al orden de llenado de la configuración electrónica, la tabla periódica se puede dividir en cuatro bloques, cada uno representado por el orbital que es ocupado al último.
Da clic en cada botón para conocer cómo se organizan estos bloques.
Las primeras dos columnas a la izquierda de la tabla periódica (grupos IA y IIA) constituyen el bloque s.
Las seis columnas en el lado derecho de la tabla periódica (grupos IIIA al VIII A) constituyen el bloque p.
Los metales de transición (grupos B) constituyen el bloque d.
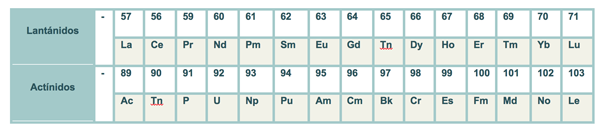
Los lantánidos y actínidos (grupo IIIB [también llamados metales de transición interna o tierras raras]) constituyen el bloque f.
Observa la siguiente imagen de la clasificación de los elementos.

Da clic en cada botón para ver la información.
A los elementos de los bloques s y p se les conoce como elementos representativos. Los del bloque s forman los grupos IA y IIA, cuyos electrones de valencia se encuentran en los subniveles ns1 y ns2, respectivamente.
Los elementos del bloque p corresponden a los grupos IIIA al VIIIA y sus configuraciones electrónicas de la capa de valencia tienen la forma ns2np1, ns2np2, ns2np3, ns2np4, ns2np5 (halógenos). Los orbitales s están llenos en todos los casos, mientras que los p van llenándose de uno en uno con electrones, conforme se avanza por el periodo.
Observa la siguiente tabla del último subnivel de la configuración electrónica de los elementos representativos.
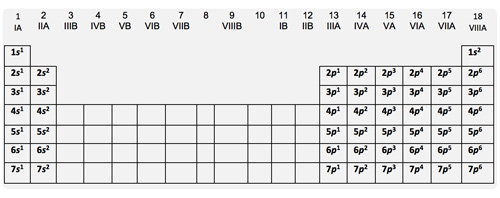
Figura 3. Último subnivel de la configuración electrónica de los elementos representativos
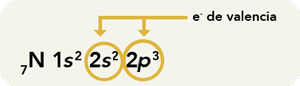
Así, por ejemplo, al analizar la posición del nitrógeno en la tabla periódica, el cual se encuentra en el grupo VA y en el periodo 2, puede deducirse que:

De aquí que sepamos que la configuración electrónica de N es la siguiente:
Aunque pertenecen al bloque p, los gases nobles merecen mención aparte ya que se caracterizan por tener llena su capa de valencia, es decir que, a excepción del Helio (que tiene únicamente dos e- en el orbital 1s), todos tienen ocho electrones en dicha capa, lo que les confiere su gran estabilidad.
La capa de valencia de los gases nobles tiene la forma ns2np6, como se puede observar:

En el caso del kriptón o criptón, el subnivel 3d no se considera parte de la capa de valencia pues pertenece a un nivel de energía más interno; se trata entonces de los subniveles de valencia 4s2 y 4p6. El xenón y el radón poseen configuraciones semejantes a la del criptón.
El bloque d está constituido por los metales de transición, los cuales pertenecen a los grupos B. Las configuraciones electrónicas de su capa de valencia tienen la forma ns2(n-1)d1, ns2(n-1)d2, ns2(n-1)d3, ns2(n-1)d4, ns2(n-1)d5, ns2(n-1)d6, ns2(n-1)d7, ns2(n-1)d8, ns2(n-1)d9, ns2(n-1)d10.
De tal manera que al desplazarnos a lo largo de un periodo los electrones van llenando al subnivel d de uno en uno. En este caso, el número cuántico principal (n) del subnivel energético nd que se llena es igual al número del periodo menos 1; entonces, el periodo está dado por el valor de n del subnivel ns2, pues es el más externo. Observa la siguiente imagen.

Por ejemplo, de la ubicación del Cr (grupo VIB o 6, periodo 4) puede deducirse que su configuración electrónica termina en un subnivel nd en el cual hay cuatro electrones pues al contar de izquierda a derecha éste se encuentra en el cuarto grupo del bloque d (recordemos que el orbital s está lleno, por lo que los electrones de valencia son en total 6).
Aunque se encuentra en el periodo 4, el cual corresponde al nivel energético más elevado de su configuración, el último orbital llenado es el 3d, esto se justifica pues antes de llenar el orbital 3d tuvo que llenarse completamente el orbital 4s.
Por lo tanto, la configuración electrónica del Cr es la siguiente:

Finalmente, los elementos de transición interna constituyen el bloque f (serie de lantánidos y actínidos), poseen configuraciones electrónicas de la capa de valencia de la forma ns2(n-2)f1-14.
En este bloque se observa que al llenarse los orbitales nf desde el 4f1 para el cerio hasta el 5f14 del laurencio o lawrencio el número cuántico principal del orbital f que se está llenando es igual al número del periodo menos 2.
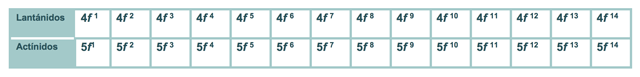
El periodo al cual pertenece la serie de los lantánidos (4f1-14) es el 6, mientras que los actínidos (5f1-14) pertenecen al 7. No obstante, ambas series corresponden al grupo IIIB o 3 ya que esos son los periodos y grupos en los que se encuentran el lantano y el actinio, respectivamente.
Así que, por ejemplo, puede deducirse que la configuración electrónica del neodimio termina en un orbital f, el cual debe tener 4 electrones pues se encuentra en la cuarta columna del bloque f, contando de izquierda a derecha. Y como pertenece a la serie de los lantánidos, los cuales corresponden al periodo 6, entonces el último subnivel debe ser el 4f4.

Pese a que hay 4 electrones (6s2 4f4) después del subnivel 5p6 (es decir, de la configuración electrónica del Rn) se considera que los electrones de valencia son sólo 3 pues el bloque f pertenece al grupo IIIB o 3.
Como bien habrás podido deducir, la serie de los lantánidos toma su nombre del lantano que es el elemento que inicia la serie que va del lantano al lutecio y la de los actínidos del actinio que va de éste al laurencio.