Propiedades periódicas
Ley periódica
Cuando nos desplazamos verticalmente por los grupos u horizontalmente por los periodos de la tabla periódica se puede notar que hay un cambio relativamente uniforme en las propiedades que exhiben los elementos, razón por la cual se conoce a éstas como propiedades periódicas.
La ley periódica nos dice que si ordenamos los elementos según su número atómico creciente encontramos en forma periódica elementos que tienen propiedades químicas y físicas semejantes. Los elementos de un grupo tienen propiedades similares, mientras que las propiedades de los elementos de un periodo cambian de manera progresiva al recorrer la tabla (Whitten, 2008, p.120).
Las tendencias observadas en las propiedades periódicas como el radio atómico, energía de ionización y afinidad electrónica, entre otras, guardan relación con las configuraciones electrónicas y carga nuclear efectiva de los elementos, por lo que permiten explicar y predecir el comportamiento químico y las propiedades físicas de aquellos que se encuentran en un mismo grupo o periodo.
Radio atómico
Actualmente se visualiza a los átomos como partículas sumamente pequeñas de forma esférica en cuyo centro se halla el núcleo (con protones y neutrones) y alrededor del cual se encuentran los electrones.
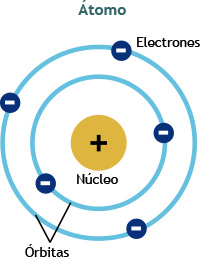
Por lo anterior, se puede decir que el tamaño de un átomo está dado por su radio atómico, el cual podría definirse como la distancia existente entre el núcleo y el electrón más lejano a él.
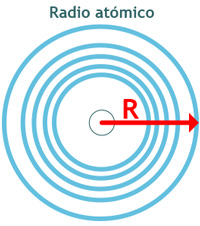
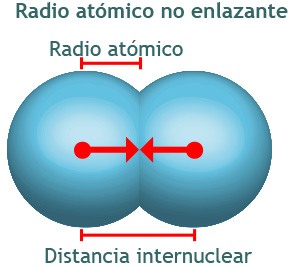
Sin embargo, debido a que la nube electrónica que rodea al núcleo no tiene límites definidos, el tamaño de un átomo está determinado por su interacción con los átomos que lo rodean. Una forma de estimar el radio atómico radica en considerar la distancia existente entre los núcleos de dos átomos adyacentes.
Imagina un conjunto de átomos de argón en forma gaseosa. Cuando dos átomos chocan entre sí, en el transcurso de sus movimientos rebotan en forma parecida a como lo hacen las bolas de billar. Detengámonos en el momento en que dos átomos se hallan en el punto donde se encuentran más juntos durante el choque, en ese instante la distancia que separa a los núcleos es el doble de los radios de los átomos; es decir, el radio de cada átomo es equivalente a la mitad de esa distancia. A este tipo de radio se le podría llamar radio atómico no enlazante pues los átomos no están formando moléculas (Brown, LeMay, Bursten, Murphy y Woodward, 2014, p.254).
Los átomos son tan diminutos que la unidad de longitud que se utiliza para expresar el radio atómico son los ångström o ángstrom (Ǻ). Un ångström equivale a 1x10-10 m, que es una distancia sumamente pequeña pues 1 Ǻ es la diezmillonésima parte de un milímetro. El radio de un átomo de cesio, que es prácticamente el elemento más grande de la tabla periódica (sólo superado por el francio), se ha estimado en 2.65 Ǻ, en tanto un átomo de helio, que es el más pequeño, mide tan sólo 0.31 Ǻ.

Los científicos han desarrollado una variedad de técnicas experimentales para medir las distancias que separan a los núcleos en una molécula. Con base en observaciones de esas distancias, en muchas moléculas es posible asignar a cada elemento un radio atómico de enlace. Por ejemplo, en la molécula de I2, la distancia que separa los núcleos de yodo (I─I) es de 2.66 Ǻ, por lo que el radio atómico de enlace del yodo es de 1.33 Ǻ (Brown, et al. 2014, p. 254).

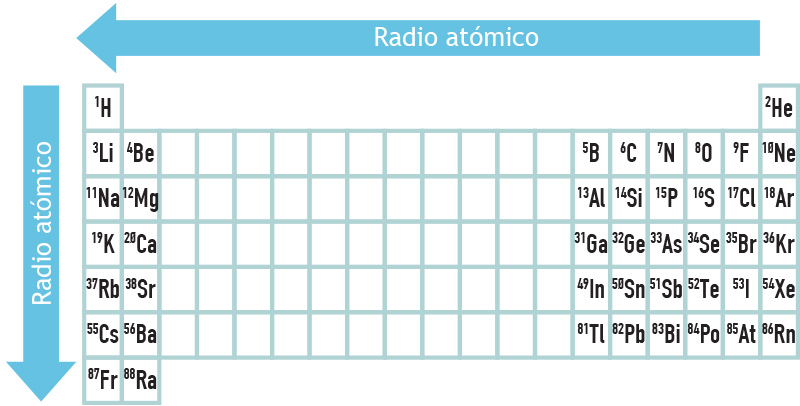
Al desplazarnos de arriba hacia abajo por un mismo grupo de la tabla periódica el radio atómico de los elementos tiende a aumentar, esto se debe a que los electrones van ocupando orbitales de niveles de energía cada vez más alejados del núcleo. O sea, que los electrones de valencia de los elementos del periodo 1 ocupan orbitales del nivel 1, los del periodo 2 del nivel 2, los del periodo 3 del nivel 3 y así sucesivamente (por ejemplo, si nos desplazamos por el grupo IA, el electrón de valencia del hidrógeno ocupará el orbital 1s, el del litio el 2s, el del sodio el 3s… el del francio el 7s).
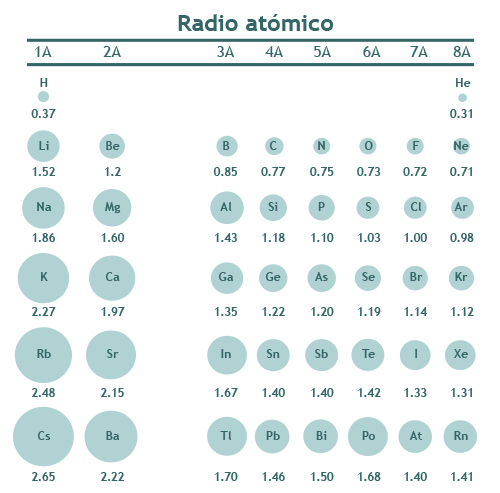
Por otro lado, cuando recorremos un periodo de izquierda a derecha el radio atómico de los elementos representativos (bloques s y p) disminuye. Lo anterior podría parecer extraño pues al aumentar el número atómico (Z) va aumentando el número de electrones que rodea al núcleo, sin embargo, los e- de la capa más externa van llenando orbitales del mismo nivel de energía, así que podría decirse que van poblando orbitales que se encuentran a la misma distancia del núcleo. Ten en cuenta que al aumentar Z, también aumenta la cantidad de protones, por lo que la atracción que ejercen sobre los electrones también irá aumentando, de manera que al desplazarnos por el periodo la carga nuclear efectiva aumenta, ocasionando que el radio atómico disminuya.

Radio iónico
Radio de cationes
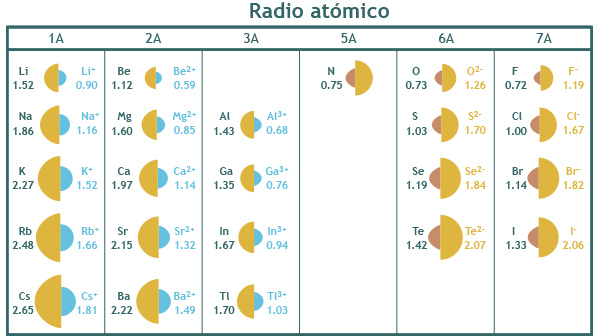
Cuando los átomos pierden electrones dejan de ser eléctricamente neutros y quedan cargados positivamente (formando cationes) pues el número de protones es mayor que el de electrones.
Esta desigualdad entre protones y electrones provoca que el radio atómico disminuya debido a que la carga nuclear efectiva aumenta. Es decir, la atracción que ejercen los protones sobre los electrones restantes es mayor que la que ejercían sobre los electrones del átomo original.
Por ejemplo, en un átomo de Ca en estado fundamental (Z=20) hay 20 protones (p+) que atraen hacia el núcleo a 20 electrones (e-). Al perder dos e- se forma el ion calcio (Ca2+), en consecuencia los 20 p+ deben atraer tan sólo a los 18 e- restantes, por lo que la fuerza de atracción que ejercen sobre éstos últimos es mayor.
Por lo anterior, es posible decir que los radios de los cationes siempre son menores que los radios de los átomos neutros de los cuales proceden.
Radio de aniones
Por el contrario, cuando un átomo de un elemento gana electrones, formando un anión, el radio atómico tiende a aumentar, esto se debe a que los protones deben atraer hacia el núcleo a un mayor número de electrones que los que atraían en el átomo neutro, por lo que la intensidad con que los atraen es menor.
Así tenemos, por ejemplo, que en un átomo de cloro (Cl) con Z=17 existen 17 p+ y 17 e-, pero al ganar un electrón formándose el ion cloruro (Cl1-) los mismos 17 p+ del núcleo deben atraer ahora a 18 e-, por lo que la fuerza de atracción que ejercen sobre ellos disminuye.
En consecuencia, es posible decir que los radios de los aniones siempre son mayores que los radios de los átomos neutros de los cuales proceden.
Energía de ionización
La afinidad electrónica, energía de ionización y electronegatividad nos dan información acerca del comportamiento químico de los elementos. Con base en ellas puede predecirse cómo se combinarán éstos y el tipo de enlace que formarán.
La energía de ionización (EI) es aquella energía que debe aplicarse a un átomo de un elemento en estado fundamental para que éste libere un electrón y, en consecuencia, forme un catión con carga de 1+.
Por ejemplo, para el calcio, la primera energía de ionización (EI1) es de 599 kJ/mol:


La segunda energía de ionización siempre es mayor que la primera ya que es más difícil separar a un electrón de un catión que de un elemento en estado fundamental debido a la atracción que ejercen los protones del núcleo sobre los electrones restantes.
Es importante que comprendas y tomes en cuenta que los átomos son eléctricamente neutros, lo cual quiere decir que el número de protones (+) y electrones (-) son iguales. Como bien sabes, dicha información se expresa mediante el número atómico (Z).
En el caso del calcio (Ca), que tiene Z=20, en estado fundamental, los 20 protones del núcleo atraen hacia sí a los 20 electrones que se encuentran en los orbitales con cierta intensidad; pero cuando el átomo de Ca ha perdido un electrón, formando al ion Ca1+, los 20 protones atraerán a los electrones restantes hacia el núcleo con mayor intensidad puesto que sólo han quedado 19 e-. En consecuencia, deberá aplicarse mayor fuerza (energía) para poder separar a un segundo electrón y formar un catión de carga 2+.
Por dicha razón, la segunda energía de ionización (EI2) siempre es mayor que la primera, así que para el calcio la EI2 es:
Las energías de ionización siempre aumentan en el siguiente orden:

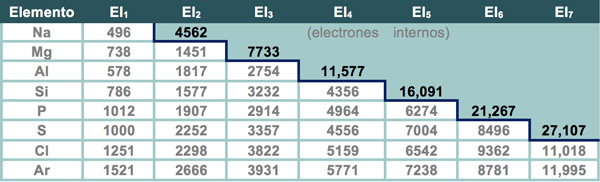
En la tabla que se muestra a continuación puedes observar cómo aumentan las energías de ionización sucesivas para los elementos del periodo 3.
De manera general, el proceso mediante el cual se forman cationes podría expresarse de la siguiente manera:
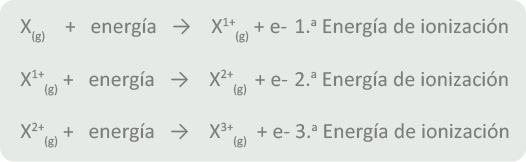
Retomando al calcio, la primera energía de ionización también podría expresarse como:

El hecho de que las energías de ionización tengan signo positivo significa que se debe aplicar energía al átomo para que éste libere un electrón. Por lo tanto, la formación de cationes es un proceso endotérmico.
Los metales tienen bajas energías de ionización, por lo que fácilmente pueden perder electrones y, por lo tanto, formar cationes.
Afinidad electrónica
Podría decirse que afinidad electrónica es lo contrario a energía de ionización ya que se trata de aquella energía que se libera cuando un átomo de un elemento en estado gaseoso gana un electrón y forma un anión con carga de 1-.

Así para el cloro cuando se forma el ion cloruro, este proceso puede expresarse como:

O bien, como:

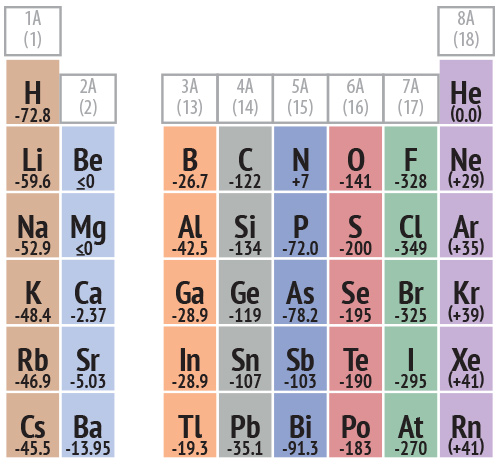
Por lo tanto, la afinidad electrónica del cloro es de -349 kJ/kmol. El signo negativo significa que la energía se libera, es decir, que es un proceso exotérmico.
Los no metales presentan altas afinidades electrónicas, por lo que fácilmente pueden aceptar electrones y formar aniones.

Si aún no te ha quedado claro lo que es energía de ionización y afinidad electrónica y cuál es su diferencia, da clic en el botón y lee con atención el siguiente ejemplo.
Da clic en cada botón para conocer la información.
Cuando vamos a la tienda a comprar algún producto, por ejemplo un refresco que cuesta $10, los compradores debemos dar al vendedor $10 para podernos llevar el refresco. Esta es la situación que se da cuando se forman aniones, sólo que en lugar de $10 el precio que “paga” el átomo por obtener un electrón es la energía llamada afinidad electrónica.
Ahora bien, si vemos las cosas desde el punto de vista del vendedor, cuando él reciba los $10, entonces le dará el refresco al comprador. Ésta es una situación análoga a lo que sucede cuando se forman cationes, pero en este caso cuando el átomo reciba una cantidad de energía equivalente a su energía de ionización, entonces liberará un electrón.
Finalmente, tanto la energía de ionización como la afinidad electrónica tienden a aumentar al desplazarnos de arriba hacia abajo por los grupos y de izquierda a derecha por los periodos de la tabla periódica.
Metales, no metales y metaloides
El radio atómico, energía de ionización y afinidad electrónica son propiedades de átomos individuales, sin embargo, al agrupar a los elementos en tres grandes categorías: metales, no metales y metaloides es posible observar que los que pertenecen a cada una de ellas presentan propiedades similares.
En la siguiente figura es posible observar dicha clasificación. Es importante indicar que aunque el hidrógeno se encuentra en el grupo IA pertenece a los no metales.
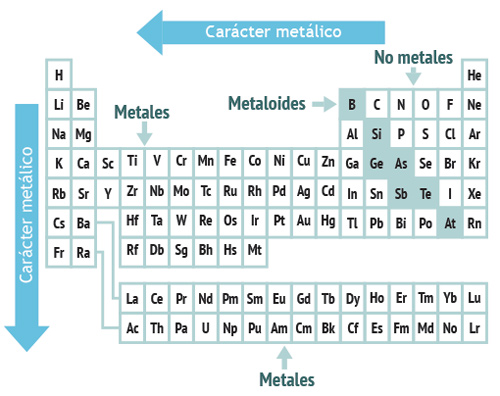
Cuando un elemento exhibe en mayor medida las propiedades físicas y químicas de los metales mayor será su carácter metálico. El carácter metálico de los elementos aumenta al desplazarnos de derecha a izquierda por un periodo y de arriba a abajo por un grupo de la tabla periódica.
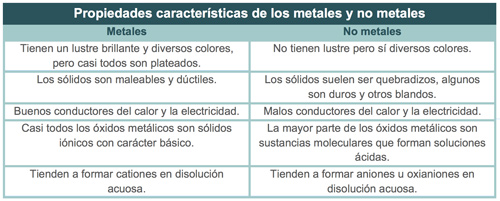
La mayor parte de los metales presentan lustre brillante, conducen el calor y la electricidad, son maleables y dúctiles. Todos son sólidos a temperatura ambiente, con excepción del mercurio (punto de fusión = -39 °C) que es un líquido. Dos metales se funden a temperaturas un poco mayores que la ambiente: el cesio a 28.4 °C y el galio a 29.8 °C. En el otro extremo, muchos metales se funden a temperaturas muy altas, por ejemplo, el cromo se funde a 1900 °C.
Como recordarás, debido a sus bajas energías de ionización, los metales tienden a perder electrones, por lo que fácilmente pueden formar cationes.
Los compuestos de metales con no metales suelen ser sustancias iónicas, como las sales binarias, por ejemplo: el bromuro de aluminio (AlBr3).
Los no metales varían considerablemente en su apariencia, no son lustrosos y generalmente son malos conductores del calor y de la electricidad. Sus puntos de fusión generalmente son más bajos que los de los metales (aunque el diamante, una forma de carbono, se funde a 3570 °C). Siete no metales existen en condiciones ordinarias como moléculas diatómicas; cinco de ellos son gases (H2, N2, O2, F2 y Cl2,), uno es líquido (Br2) y uno es un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre.
Cabe recordar que debido a sus altas afinidades electrónicas los no metales al reaccionar con metales tienden a ganar electrones. Por ejemplo, la reacción entre aluminio y bromo produce bromuro de aluminio, un compuesto que contiene al ion aluminio Al3+ y al ion bromuro Br1- .

Los no metales generalmente ganan suficientes electrones para llenar su subcapa p exterior por completo, a fin de alcanzar una configuración electrónica de gas noble. Por ejemplo, el átomo de bromo gana un electrón para llenar su subcapa 4p:

Los compuestos formados en su totalidad por no metales son sustancias moleculares. Por ejemplo, los óxidos, halogenuros e hidruros de los no metales son sustancias moleculares que suelen ser gases líquidos o sólidos de bajo punto de fusión a temperatura ambiente.
Los metaloides tienen propiedades intermedias entre las de los metales y los no metales; podrían tener algunas propiedades características de los metales, pero carecer de otras. Por ejemplo, el silicio parece un metal pero es quebradizo en lugar de maleable y no conduce el calor y la electricidad tan bien como los metales. Varios de los metaloides, destacando el silicio, son semiconductores eléctricos y constituyen los principales elementos empleados en la fabricación de circuitos integrados y chips para computadoras.

En resumen, hay que recordar que el radio atómico corresponde a la mitad de la distancia que existe entre los núcleos de dos átomos adyacentes,o bien, a la distancia existente entre el núcleo y el electrón más alejado a él. Los radios atómicos se miden en ångström (Ǻ).
La energía de ionización es aquella energía que debe aplicarse a un átomo de un elemento en estado fundamental para que éste libere un electrón y forme un catión. Mientras que la afinidad electrónica es aquella energía que se libera cuando un átomo de un elemento gana un electrón y, de esta manera, forma un anión.
Al desplazarnos de arriba hacia abajo por un mismo grupo y de derecha a izquierda por un periodo de la tabla periódica el radio atómico de los elementos tenderá a aumentar, en tanto que la afinidad electrónica y la energía de ionización aumentan en forma inversa, es decir, de abajo hacia arriba y de izquierda a derecha.
En cuanto al radio de los iones hay que tener presente que el radio de los cationes siempre es menor que el radio de los átomos de los cuales proceden, mientras que el de los aniones es mayor.
Al agrupar a los elementos en metales, no metales y metaloides se observa que éstos presentan propiedades semejantes. En el caso de los metales éstos tienen lustre brillante, son buenos conductores del calor y la electricidad, son maleables y dúctiles; los no metales varían considerablemente en su apariencia, no son lustrosos y generalmente son malos conductores del calor y de la electricidad, y los metaloides presentan propiedades intermedias entre los metales y los no metales.
El carácter metálico de los elementos aumenta al desplazarnos de arriba hacia abajo por un grupo y de derecha a izquierda por un periodo de la tabla periódica.
Debido a sus bajas energías de ionización los metales tienden a perder fácilmente electrones, por lo que es sencillo que formen cationes. Los no metales, debido a su alta afinidad electrónica, tienden a ganar electrones por lo que fácilmente pueden forman aniones.
Por lo anterior, los metales no reaccionan entre sí pero al combinarse químicamente metales con no metales tienden a formar compuestos iónicos, como las sales binarias. Con respecto a los no metales, éstos sí pueden formar compuestos entre sí, los cuales son sustancias moleculares, por ejemplo, los óxidos no metálicos, halogenuros, hidruros de los no metales y los gases diatómicos como el H2 y el N2. .