"Prácticamente todas las sustancias que encontramos en la naturaleza están constituidas por átomos unidos. Las intensas fuerzas que mantienen unidos a los átomos en las distintas sustancias se denominan enlaces químicos".
Enlace entre átomos
¿Por qué se unen los átomos?
"Los átomos se unen porque al estarlo adquieren mayor estabilidad química que al momento de encontrarse en estado neutro, es decir, cuando están separados".
"Esta situación de mayor estabilidad suele ocurrir cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles".
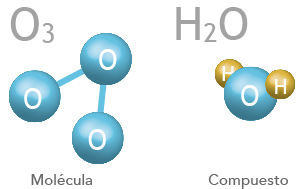
Molécula y compuesto
Las moléculas se forman en el momento que los átomos se unen mediante un enlace químico llamado covalente. Cuando se unen átomos del mismo elemento forman moléculas simples, por ejemplo: O2, H2, N2; cuando se unen dos o más átomos de distintos elementos mediante un enlace químico y en una proporción fija en masa se forman los compuestos, por ejemplo: H2O, NaCl, Ca3(PO4)2.
Las moléculas se representan mediante fórmulas químicas y en sí mismas simbolizan la parte más pequeña de una sustancia; los compuestos se representan mediante fórmulas en donde se indica con cada subíndice la cantidad de átomos de cada elemento que participa.
Wegener Tesla (2012). MOLÉCULAS y SUSTANCIAS PURAS PASO A PASO. Ejemplos de sustancias puras famosas. [Archivo de video]. Recuperado de https://youtu.be/fzWnRh-TDgg
Configuración electrónica en gases nobles
Anteriormente se había mencionado que las sustancias que encontramos en la naturaleza, en su mayoría, están conformadas por átomos unidos y que “las intensas fuerzas que mantienen unidos a los átomos en las distintas sustancias se denominan enlaces químicos”, situación de mayor estabilidad a la que ya se ha hecho referencia.
¿Por qué o para qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados.
Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.
La configuración electrónica de todos los gases nobles, con excepción del helio (He), es que terminan llenando el nivel externo con 8 electrones, es decir, 2 electrones en el subnivel “s” y 6 electrones en el subnivel “p”.
En el grupo VIIIA de la tabla periódica (Figura 1) se muestra que conforme al número atómico que poseen, la cantidad de electrones que tienen en el último nivel de energía corresponde a los 2 electrones del subnivel “s” y los 6 electrones del subnivel “p” en diferente nivel de energía.
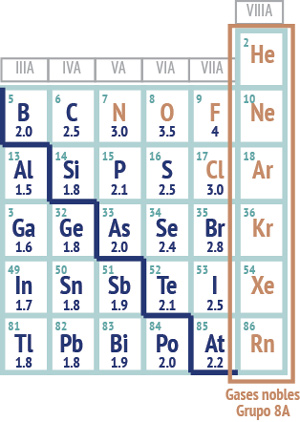
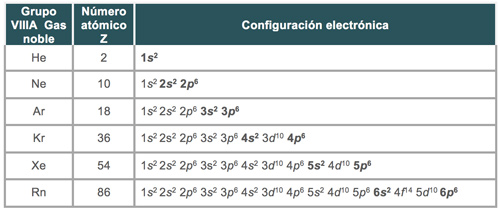
Estas configuraciones electrónicas terminan con 8 electrones en el último nivel de energía, a excepción del helio (He), lo cual permite que estos elementos sean muy estables, por ello cuando los elementos se unen mediante enlace buscan completar 8 electrones en su último nivel para ser estables como lo son los gases nobles.
Regla del octeto
La regla del octeto se cumple cuando los elementos al unirse mediante enlace ceden o comparten electrones con el objetivo de completar 8 electrones en el último nivel de energía.
Estructura de Lewis
El científico Lewis determinó la forma de representar los enlaces químicos al emplear los electrones de valencia de los átomos. A esta representación se le conoce como estructura de Lewis o fórmula electrónica y consiste en dibujar puntos o cruces alrededor del símbolo del elemento, los cuales indican la cantidad de electrones de valencia que posee el átomo respectivo.
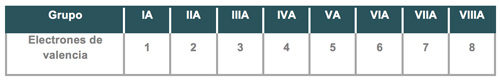
Los electrones de valencia son los que se encuentran en el último nivel de energía y ello se logra al efectuar la configuración electrónica de los átomos, sin embargo, existe una forma más directa para determinar esta cantidad de electrones que consiste en ubicar en qué grupo se encuentra el elemento, siempre y cuando se trate de un elemento representativo del grupo A, es decir, de elementos del grupo IA ya que poseen un (1) electrón de valencia y así progresivamente.
Observa el siguiente ejemplo:
Ahora, ve los ejemplos de las estructuras de Lewis:

En el cuadro anterior se muestra una serie de ejemplos de símbolos de elementos con la representación relativa a la cantidad de electrones de valencia que posee cada uno, ello se ha realizado con ayuda de la tabla periódica para localizar a qué grupo pertenece, por ejemplo: el hidrógeno (H) se encuentra dentro del grupo IA, por lo tanto, tiene 1 electrón de valencia, el boro (B) se halla en el grupo IIIA, consiguientemente, tiene 3 electrones de valencia, situación que se da en forma consecutiva.

