Propiedades de las sustancias a partir del tipo de enlace químico.
Bases de la hibridación y polaridad de la molécula
Hibridación
Para entender la geometría de las moléculas se consideró la hibridación, la cual permitió justificar su geometría ya que la valencia no la podía explicar.
Todas las moléculas están en un sistema tridimensional (largo, ancho y alto), por lo que se considera que se encuentran ocupando un lugar en el espacio.
Al considerar la molécula CH4 y analizar los electrones desapareados que presenta el carbono, o bien, los electrones de valencia su diagrama se representa de la siguiente forma:
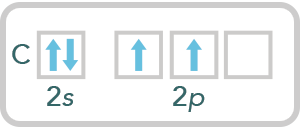
Como se observa, tiene dos electrones desapareados, sólo podría formar dos enlaces con el hidrógeno en estado basal y, a pesar de que se conoce, la especie CH2 es muy inestable. Para explicar los cuatro enlaces de C-H en el metano se puede mover un electrón (excitación energética), un electrón del orbital 2s al orbital 2p.

Siguiente paso: como el carbono queda con sus cuatro electrones desapareados y el electrón del subnivel s saltó al último orbital del subnivel p, es decir al pz, éstos se conjugan o se mezclan para obtener nuevos orbitales híbridos, los cuales quedan de esta manera:
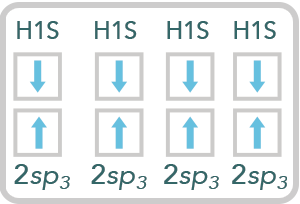
La molécula se expresa así: CH4
Observa la siguiente tabla ya que te ayudará a comprender las diferentes formas que tiene una molécula con base en su hibridación, así como las diversas hibridaciones que es capaz de presentar un elemento, lo que significa que se pueden tener una, dos o tres hibridaciones posibles para los elementos representativos o del bloque A de la tabla periódica.
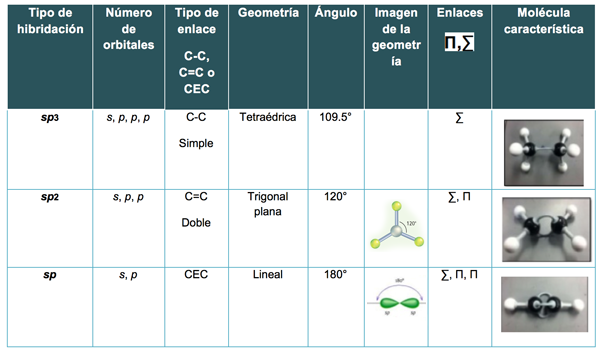
Tabla 1. Hibridaciones del carbono, sus enlaces y formas en el espacio
Todos los elementos representativos pueden sufrir este fenómeno; como se mencionó anteriormente, es la manera de justificar los enlaces que presentan los compuestos, así como la forma que tienen en el espacio.
Con base en el diagrama energético de los elementos te darás cuenta de cómo pueden unirse, cuántos enlaces tienen y si el enlace es sencillo, doble o triple. Por ejemplo:
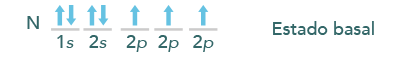
Para poderse hibridizar es necesario que el electrón de 2s se excite y así pase al siguiente: 2p, lo cual queda representado de la siguiente manera:
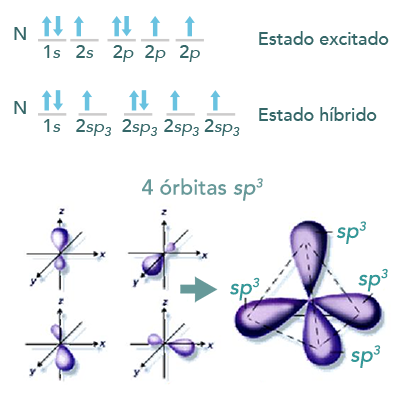
Forma en el espacio
Estos orbitales híbridos se hallan listos para formar el enlace químico y de esto se derivan sus propiedades, tanto físicas como químicas. Por otro lado, la hibridación da la forma de la molécula en el espacio y, por lo mismo, tiene una polaridad que también marca ciertas propiedades de las sustancias.
Observa la siguiente tabla referente a la representación del tipo de hibridación que da forma a la molécula en el espacio.

Lillo, N. (2009). Molécula de nitrógeno.
Recuperado de https://youtu.be/NWqCTfChocE
Enlace polar y polaridad de una molécula
El enlace polar es una medida acerca de lo que tan equivalentemente se comparten los electrones de un enlace entre los dos átomos que se unen; a medida que aumenta la diferencia de electronegatividad entre los dos átomos aumenta la polaridad de la molécula.
Con respecto a las moléculas con más de dos átomos, el momento dipolar depende tanto de las polaridades de los enlaces individuales como de la geometría de la molécula, es decir, del momento dipolar debido únicamente a los dos átomos de ese enlace.
Por ejemplo, en la Figura 1 se considera a la molécula de CO2; cada enlace de C= O es polar y dado que los enlaces C = O son idénticos los momentos dipolares tienen la misma magnitud.
Además, el modelo de densidad electrónica se encuentra en los extremos de la molécula; ya que el átomo de oxígeno tiene más electrones que el carbón éste es más negativo. Los dipolos de enlace y los momentos dipolares con cantidades vectoriales tiene magnitud, así como dirección.
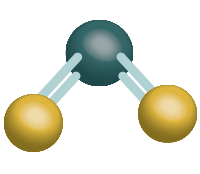
Figura 1. Representación de la hibridación del carbono sp para la molécula del CO2
El momento dipolar global de una molécula poliatómica es la suma de sus dipolos de enlace. En esta suma de vectores debemos considerar tanto la magnitud como la dirección de los dipolos de enlace. Los dipolos de enlace del CO2, si bien tienen la misma magnitud, sus direcciones son totalmente opuestas, por tanto, el momento dipolar global de CO2 es cero, aunque los enlaces individuales sean polares.
Propiedades de la sustancia con base en su estructura y tipo de enlace
Las moléculas polares neutras se atraen cuando el extremo positivo de una de ellas está cerca del extremo negativo de otra.
En la imagen (Figura 2) se muestra que estas fuerzas dipolo-dipolo sólo son eficaces cuando las moléculas polares están muy juntas y generalmente son más débiles que las fuerzas ion-dipolo.
En los líquidos las moléculas polares están en libertad, como se muestra en la Figura 3. Cuando las moléculas se atraen pasan más tiempo atraídas que dos que se repelen. Para las moléculas con masa y tamaño aproximadamente iguales la intensidad de las atracciones intermoleculares aumenta al incrementar la polaridad.
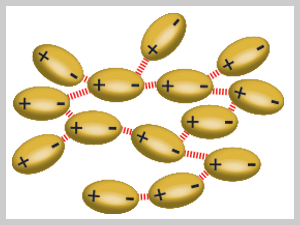
Figura 2. Atracción que existe entre las moléculas polares
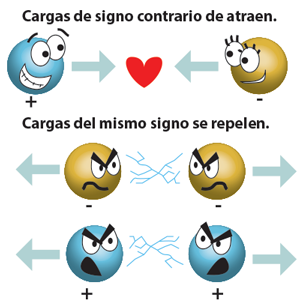
Figura 3. Atracción de las moléculas polares y cómo se rechazan las moléculas del mismo signo
El punto de ebullición aumenta cuando aumenta el momento dipolar, es decir, las moléculas entre más se encuentran atraídas incrementan la dificultad para poderse separar, también nótese que los enlaces covalentes que en su mayoría son las sustancias orgánicas y algunas inorgánicas tienen puntos de ebullición bajos ya que es un enlace más débil que los iónicos que presentan la mayoría de las sales inorgánicas y orgánicas que pueden tener puntos de ebullición un poco menores a las inorgánicas.
Observa la siguiente tabla.
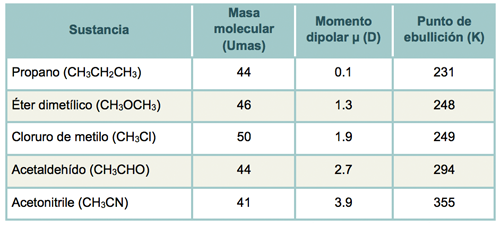
Tabla 3. Masas moleculares, momentos dipolares y punto de ebullición de varias sustancias orgánicas simples
La siguiente tabla muestra algunos puntos de ebullición de sustancias de diferentes hidrocarburos, los cuales están referidos a sus pesos moleculares y a los diferentes puntos de ebullición y de fusión.
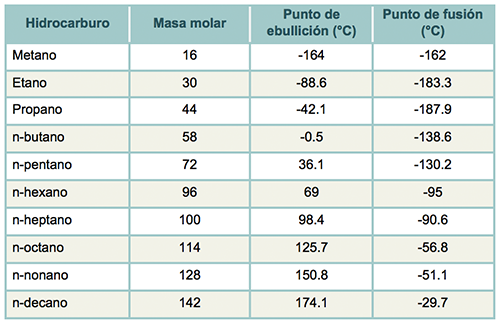
Tabla 4. Puntos de ebullición y fusión de hidrocarburos
En la Tabla 5 se presenta la relación que tienen algunas sustancias con respecto a la temperatura y su solubilidad con porcentaje en peso de soluto y solución.
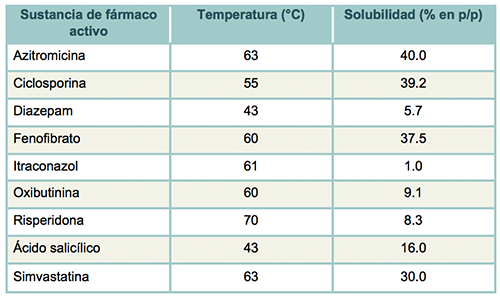
Tabla 5. Tabla de sustancias y su relación con la temperatura y la solubilidad
Las propiedades se pueden identificar por medio de la forma de la molécula en el espacio. Las moléculas tienen una forma y un volumen, por lo mismo ocupan poco o mayor espacio, ello propicia las diferentes propiedades físicas como el punto de ebullición, fusión, solubilidad y puente de hidrógeno.
Las propiedades de las sustancias se encuentran sujetas al tipo de hibridación que presenta la molécula ya que ésta puede formar moléculas polares y no polares; también es posible que presenten altos puntos de fusión y de ebullición; pueden conducir la corriente eléctrica; y logran disolverse, en el caso de esta propiedad se debe considerar que las moléculas polares disuelven a las polares y que las sustancias que presentan moléculas no polares se disuelven en moléculas no polares.
De igual forma, su peso molecular es otro factor importante ya que éste muestra el tamaño de la molécula y los enlaces químicos marcan de una forma definitiva si la molécula puede romperse fácilmente o no. El puente de hidrógeno, a pesar de no ser propiamente un enlace, es la atracción que existe entre el hidrógeno y otra parte de la molécula que tiene cargas negativas, su atracción es tal que aumenta el punto de ebullición de una forma considerable, como en el caso del agua ya que proviene de dos gases y el resultado es que el agua es líquida.
En suma, en este apartado conociste las propiedades de las sustancias a partir del tipo de enlace químico, así como las bases de la hibridación y la polaridad de la molécula. Es importante que las tomes en cuenta ya que te serán de utilidad para comprender el siguiente tema.


