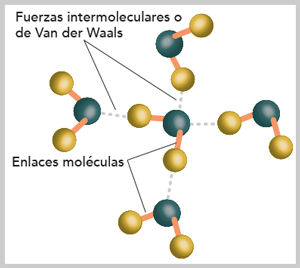
Enlace entre moléculas
Entre los átomos, iones y moléculas de las sustancias existen fuerzas que se atraen, a éstas se les llama intermoleculares, en algunas son débiles y en otras intermedias o fuertes. La existencia de la molécula se debe a estas fuerzas, por ejemplo, se requieren 920 kJ de energía para descomponer un mol de vapor de agua en átomos de hidrógeno (H) y oxígeno (O), lo que indica la fuerza intermolecular existente (enlace químico), pero solamente se requiere 40.7 kJ para convertir una mol de agua líquida en vapor de agua a 100 °C (en este caso se reflejan estas fuerzas intermoleculares).
La formación de las fases se debe precisamente a las fuerzas, cuando se produce la fase líquida o sólida se mantienen unidos, por efecto de este fenómeno, los puntos de ebullición.
Las sales NaCl, CaBr2 y K2SO4 presentan enlace iónico, sus iones son discretos en estado sólido, su enlace es fuerte y casi todos presentan puntos de fusión altos.
Interacción dipolo-dipolo
En las moléculas covalentes existen interacciones dipolo-dipolo permanentes debido a la atracción de los momentos alfa con carga positiva (+) de una molécula con respecto a los momentos alfa con carga negativa (–) de otra.
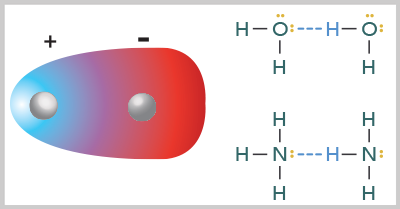
Puente de hidrógeno
En realidad no se trata de enlaces químicos sino de una interacción dipolo-dipolo muy fuerte. El puente de hidrógeno se presenta en los compuestos cuyo enlace covalente esté contenido en el hidrógeno (H) y otros elementos de alta electronegatividad como el flúor (F), oxígeno (O) o nitrógeno (N) y se forma por la interacción dipolo-dipolo.
Distorsión de la nube electrónica entre dos átomos de diferente electronegatividad
Para comprender el enlace químico hay que apoyarse en varias estrategias didácticas como el conocimiento de los elementos en la tabla periódica donde se encuentran los números de electrones que tienen en su último nivel, éstos son los electrones de valencia y los electrones de enlace que con sus símbolos, así como por medio del diagrama de Lewis, es posible comprender la manera en la que se enlazan los elementos para constituir las moléculas, éstas al formar diferentes enlaces químicos (iónico, covalente, metálico y puente de hidrógeno) y gracias a la hibridación tienen diversas formas en el espacio, por ende, presentan moléculas polares y no polares, lo que da como resultado diferentes propiedades, por ejemplo: conductividad eléctrica, térmica, solubilidad, punto de fusión y punto de ebullición, que están perfectamente relacionadas con el enlace químico y la hibridación que da la forma de la molécula en el espacio.
En esta unidad has adquirido las competencias necesarias que te permitirán predecir las propiedades físicas presentes en las sustancias, dependiendo del tipo de enlace existente entre los átomos o moléculas que conforman el compuesto o sustancia.
Por lo anterior, has revisado diversos conceptos alrededor del enlace químico, así como comprendido que se parte del fundamento de que el enlace es una fuerza que mantiene unidos a los átomos por medio de ceder, transferir, compartir o aportar electrones de valencia y lograr, de este modo, adquirir una configuración semejante a la de un gas noble. De igual forma, conociste cuál es la clasificación del enlace químico y reconociste la existencia del enlace entre átomos y moléculas.
Ahora puedes señalar cuáles son las características de cada uno de los tipos de enlace químico: iónico, covalente polar, covalente no polar, covalente coordinado, metálico y puente de hidrógeno, apoyándote para su representación con el diagrama de Lewis, también predecir las propiedades físicas que presentan las sustancias derivadas del tipo de enlace, entre ellas: solubilidad, punto de fusión, punto de ebullición, conductividad eléctrica, conductividad térmica, dureza, maleabilidad y ductilidad.
Reconocerás que a partir del concepto de hibridación puedes identificar la forma geométrica que tienen las moléculas y con ello discriminar si se trata de una molécula polar o no polar, independientemente del tipo de enlace que presenta y así deducir ciertas propiedades físicas que muestran las sustancias.

