Formulación y lenguaje químico
El emplear un lenguaje químico, además de hacerte sentir “muy científico”, hace posible una adecuada comunicación en diferentes situaciones, ya sea al traducir el lenguaje verbal a uno simbólico o viceversa. Así es que en este segmento aprenderás a determinar números de oxidación y a elaborar fórmulas químicas, ambos de suma utilidad para comprender las bases de la nomenclatura de las funciones químicas de compuestos inorgánicos.
Número de oxidación
Como recordarás, cuando un elemento se une químicamente a otro u otros se le asigna una carga eléctrica, considerando su electronegatividad y la distribución de los electrones en el enlace químico formado, éste es el número de oxidación o estado de oxidación que, como te darás cuenta más adelante, será práctico para dar nombre a los compuestos químicos.
Una forma rápida para fijar los números de oxidación consiste en atender las siguientes reglas:
- En las sustancias simples, es decir, formadas por un sólo elemento, el número de oxidación es cero.

- Los metales siempre tienen números de oxidación positivos.

- El oxígeno, cuando está combinado químicamente, posee un número de oxidación -2, con excepción de los peróxidos en los que actúa con número -1.

- El hidrógeno que se une a otro no metal adquiere número de oxidación +1 y al incorporarse con un metal su número de oxidación es -1.

- Los otros no metales pueden tener números de oxidación negativos y positivos, ello depende de su unión química.
Cuando se unen a un metal el no metal tendrá número de oxidación negativo; cuando se unen no metales al más electronegativo se le asigna número de oxidación negativo. El no metal menos electronegativo tendrá número de oxidación positivo.
- En un compuesto la suma algebraica de los números de oxidación de todos los átomos es igual a cero.

- En el caso de que un elemento tenga varios estados de oxidación primero se calcula el de los elementos con solamente uno y al efectuarse la suma algebraica el resultado de ésta será el estado de oxidación del elemento faltante.

Con apoyo de la tabla periódica se observa que el sodio (Na) tiene reportado un estado de oxidación +1, el oxígeno (O) -2 y el azufre (S) -2, +4 y +6, por lo que se procede de la siguiente manera:
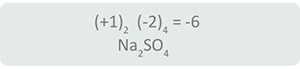
Por lo tanto, para que la suma algebraica sea igual a cero, el estado de oxidación del azufre (S) en este compuesto es +6.

Es importante señalar que una fórmula química se lee igual que una fórmula matemática, así tenemos que el compuesto:

Está formado por:
- 3 átomos de calcio (Ca)
- 2 átomos de fósforo (P)
- 8 átomos de oxígeno (O)
Al calcular el estado de oxidación de cada elemento:


Cómo elaborar fórmulas químicas
Si observas una fórmula química te podrás dar cuenta que se compone de símbolos químicos y pequeños números (subíndices) colocados a la derecha de algún símbolo, éstos nos indican el número de átomos de ese elemento que se encuentran formando el compuesto. Además, puedes observar paréntesis y fuera de ellos un subíndice que se interpreta como el número de veces que aparece en el compuesto. Por ejemplo:
Esta fórmula se lee de la siguiente manera:
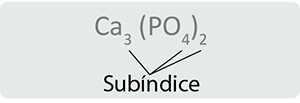
El compuesto está constituido por tres atomos; el PO4, que es el radical fosfato, se encuentra dos veces y está formado por un átomo de fósforo y cuatro átomos de oxígeno, por lo que en total hay dos átomos de fósforo y ocho de oxígeno.
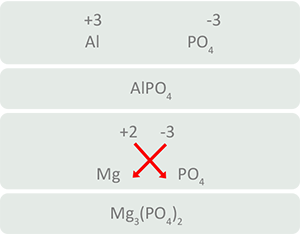
- Primero se coloca el símbolo químico de él o los elementos que tengan estado de oxidación positivo (catión), posteriormente la parte negativa (anión).
Como puedes observar, las cargas positivas y negativas se hallan en equivalencia, por lo que la suma algebraica es igual a cero. Ya no tienes que hacer más, la fórmula está hecha:

- Cuando se unen cationes y aniones con números diferentes resulta necesario cruzarlos y colocarlos como subíndices del otro elemento, de esta forma se obtienen cargas equilibradas, es decir, la suma algebraica es igual a cero.
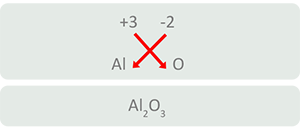
- Cuando los subíndices son pares se les quita la mitad.

Dado que el símbolo de un elemento representa la unidad no es necesario escribir el número uno como subíndice.
- Si participa un radical y éste se encuentra más de una vez resulta forzoso colocarlo entre paréntesis y fuera de éste el subíndice correspondiente

La respuesta es: Si manejo un lenguaje verbal químico debo también traducirlo a un lenguaje de símbolos.
HaydeeHBa (2010). Nomenclatura y escritura de compuestos 2. Recuperado de https://www.youtube.com/watch?v=fcAS8RffjH8
Hasta este momento has revisado lo concerniente al número de oxidación de los elementos en un compuesto, así como las reglas básicas para escribir las fórmulas químicas, temas que son indispensables para abordar los contenidos de la siguiente sección.

