Conceptos básicos de reacciones y ecuaciones químicas
En este tema comprenderás la importancia que tienen los fenómenos que modifican la naturaleza interna de las sustancias y su relación con nuestra vida cotidiana, por lo tanto, te preguntarás:


Desde tiempos inmemoriales al hombre le han llamado la atención los diversos procesos de transformación y se ha interesado por conocerlos. La razón es simple, una vez conocidos los cambios que sufre la materia se pueden controlar para beneficio de la humanidad.
En las reacciones químicas se pueden observar transformaciones, entre éstas podemos encontrar: cambio de color, precipitado, producción de un gas o cambio en la temperatura.
Por ejemplo, la formación de óxidos de hierro en una estructura constituida por una aleación de hierro expuesta a la atmósfera abierta causa un deterioro irreversible.

Formación de óxido de hierro
En la naturaleza, la velocidad con la que se llevan a cabo las reacciones químicas es variable. Algunas transformaciones son muy lentas, como la oxidación de los metales; otras muy rápidas, como la explosión de nitroglicerina.

Explosión de nitroglicerina
Al combinarse las sustancias ocurre un rompimiento de los enlaces que mantienen unidos a los átomos que las conforman, de tal manera que estos átomos se reorganizan mediante nuevos enlaces entre ellos, lo que da lugar a nuevas sustancias.
Representación de una reacción química
Describe los cambios que suceden en la naturaleza debido al reordenamiento de los átomos de la materia de forma objetiva, cuantitativa y ordenada.
Ecuaciones químicas
Una ecuación química es la representación escrita, abreviada y simbólica de una reacción química; nos proporciona un medio para mostrar un cambio químico, los reactivos y los productos, su composición atómica y la relación molecular donde interviene.
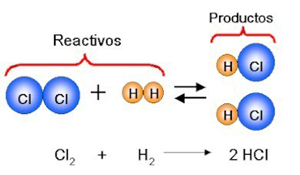
La ecuación puede ser expresada por medio de símbolos y fórmulas de las sustancias participantes, por ejemplo:

O en algunas ocasiones utilizar cualquier letra del alfabeto, por ejemplo:

Convencionalmente, a las sustancias que se escriben a la izquierda de la flecha se les llama reactivos o reactantes y constituyen el primer miembro de la ecuación.
Las sustancias escritas a la derecha de la flecha forman el segundo miembro de la ecuación y constituyen el producto de la reacción.
Ejemplo:

La siguiente tabla que se refiere a los símbolos auxiliares utilizados en una reacción química.
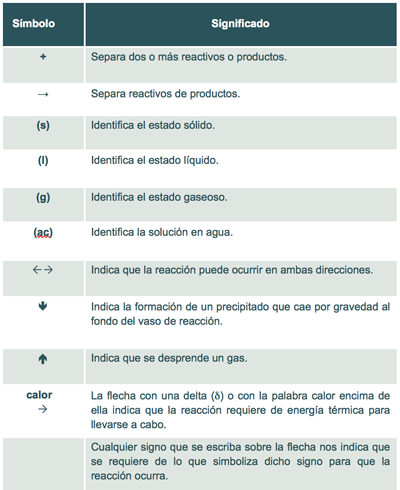
Tabla 1. Símbolos auxiliares utilizados en una reacción química
Como puedes observar, los símbolos auxiliares se emplean para que una ecuación química represente lo más exactamente posible las condiciones en que se llevan a cabo las reacciones químicas.
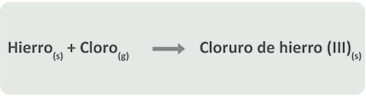
Ecuaciones químicas con palabras
El hierro en estado sólido reacciona con cloro en estado gaseoso para producir el sólido cloruro de hierro (III). Observa la siguiente imagen:
Clasificación de las reacciones químicas
Cuando se efectúa una reacción química se presentan cambios en la composición y estructura de las sustancias reaccionantes.
Para dar respuesta a esta interrogante los químicos se han auxiliado del conocimiento que tienen de las propiedades de los elementos, así como de los compuestos y las ecuaciones químicas para predecir las posibles combinaciones entre las sustancias. Los tipos de reacciones comunes en química orgánica e inorgánica son: Ácido-base (neutralización), combustión, solubilización, reacciones redox y precipitación.
WorldScienceEC (2013). EXPERIMENTOS QUÍMICOS | The Amazing Science | Ciencia Sorprendente #3. Recuperado de https://www.youtube.com/watch?v=yhRx4SuWH4s
López, M. (2011) Física y Química - Tipos de reacciones químicas. Recuperado de https://www.youtube.com/watch?v=upcdH7nvICE
Desde un punto de vista de la física se pueden postular dos grandes modelos para las reacciones químicas: reacciones ácido-base (sin cambios en los estados de oxidación) y reacciones redox (con cambios en los estados de oxidación). Sin embargo, también se clasificarán de acuerdo al tipo de productos que resultan de la reacción; en esta clasificación se encuentran las reacciones de síntesis (combinación), descomposición, de sustitución simple o de sustitución doble. De acuerdo con lo anterior, los tipos de reacciones mediante los cuales se forman los compuestos son los siguientes:
Da clic en cada uno de los recuadros para ver la información.
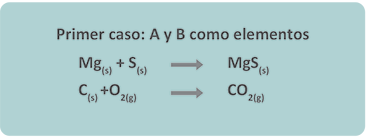
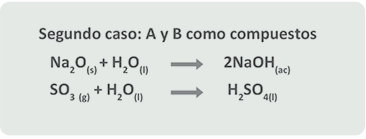
Se les llama también reacciones de unión directa o de combinación.
Las reacciones de síntesis o adición son aquéllas en las que dos o más sustancias (elementos o compuestos) se combinan para formar solamente un compuesto.
La ecuación general que representa este tipo de reacción es:

No debes olvidar que los reactivos no deben ser necesariamente sustancias simples (Fe, S, H2, O2), considera que pueden también tratarse de sustancias compuestas (CO2, H2O), pero en todas las reacciones el producto es una sustancia “menos simple” que las originales.
Considera lo anterior y revisa algunos ejemplos de reacciones de síntesis.
Son conocidas también como reacciones de análisis.
Una reacción de descomposición es la ruptura de un compuesto en dos o más componentes (elementos o compuestos)
La ecuación general es:
Por lo general, se requiere de la acción del calor o de la electricidad para que se puedan llevar a cabo. ¿No parece simple? Pues sí lo es. Algunos ejemplos de este tipo de reacción son:
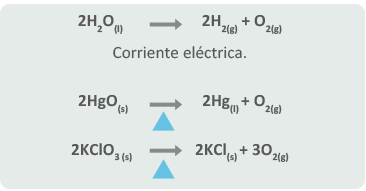
Reversibilidad de las reacciones químicas
Los ejemplos anteriores pueden sugerir que cualquier reacción de síntesis puede ser invertida a través de una reacción de análisis, esto no es verdad. Solamente algunas reacciones pueden ser reversibles, como se puede notar en la reacción del agua:
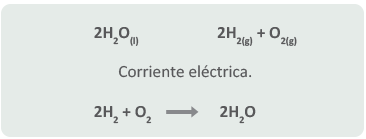
Sin embargo, no es una regla.
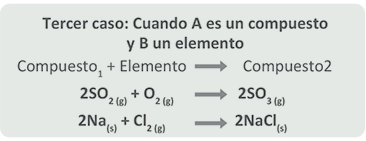
Una reacción de sustitución o desplazamiento simple es aquélla en la que reaccionan un elemento y un compuesto, y el elemento por afinidad química sustituye a otro elemento del compuesto.
Observa la siguiente ecuación general que representa esta reacción:
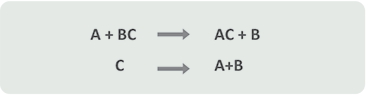
En este tipo de reacciones, A es el elemento que desplaza o sustituye y puede ser un metal o no-metal.
Para entender mejor la ecuación anterior, identifica lo que sucede con C cuando intenta cambiar de lugar y en el momento en que logra unirse a A.
Por ejemplo, imagina lo siguiente en un contexto de la vida real:
Supongamos que eres C y en un baile observas a una persona B con la que te gustaría bailar, sin embargo, se encuentra con otra persona (A). Te acercas hasta ella y la invitas a bailar e intentas que ella cambie de pareja, esto significa que estás intentando desplazar al otro acompañante y asumir su lugar.
Si resulta que eres más fuerte que éste último bastaría darle un empujón para asumir su lugar, pero si fuera al contrario posiblemente él no sentirá el empujón.
En la reacción de desplazamiento sucede lo mismo que en el ejemplo anterior. C observa a B ligado a A, entonces se aproxima y al ser más fuerte desplaza a A y asume la unión con B; pero en el caso contrario, es decir, que C no sea más fuerte que A nada sucederá.
Una forma sencilla de predecir si en realidad va a ocurrir una reacción de desplazamiento radica en consultar la serie de actividades de los metales (serie electromotriz) y la de los halógenos; estas series agrupan a los metales y los halógenos por orden de reactividad química descendiente, como se muestra en la siguiente tabla:

*El hidrógeno (H) es un no metal pero se incluye en esta tabla por su grado de reactividad.
Tabla 2. Desplazamiento en metales y halógenos
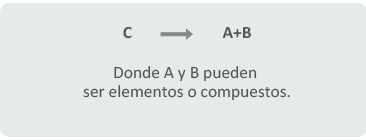
La mayoría de las reacciones de sustitución o desplazamiento simple pertenecen a los siguientes casos:
Primer caso: Cuando A es un metal en estado libre:
C→A+B
A) El metal desplaza a otro metal en su sal.
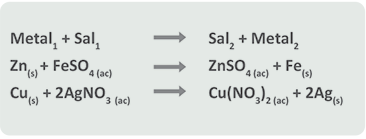
Al revisar la serie de actividades ambas reacciones se llevan a cabo ya que el cinc (Zn) es más reactivo que el hierro (Fe), y el cobre (Cu) es más reactivo que la plata (Ag), por lo que fácilmente desplazan al hierro y a la plata, respectivamente. No sucede esto en la siguiente reacción:

Si observamos la tabla de actividades, el níquel (Ni) está colocado después del sodio (Na), lo que indica que el Ni es menos reactivo que el Na y no podrá desplazar a este elemento.
B) El metal desplaza al hidrógeno del agua.
Metal + Agua → Óxido o hidróxido metálico + Hidrógeno

C) El metal desplaza al hidrógeno de un ácido (oxiácido o hidrácido).
Metal + Ácido → Sal + Hidrógeno
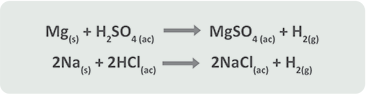
Segundo caso: Cuando A es un no metal (halógeno)
Halógeno1 + Sal de halógeno1 → Halógeno2 + Sal de halógeno2
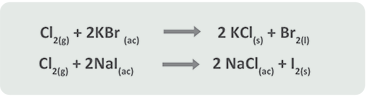
El comportamiento de los halógenos en las reacciones de sustitución o desplazamiento simple es el que se señala en la serie de actividades (Tabla 2).
Las reacciones de sustitución simple son de gran aplicación industrial, un ejemplo de ello se refiere a las reacciones en las que intervienen los halógenos, sobre todo el cloro (Cl) por ser un agente oxidante muy fuerte.
A estas reacciones también se les llama de metátesis que significa un cambio en el estado, en la sustancia o en la forma.
Las reacciones de doble sustitución son aquéllas en las que hay un intercambio de iones entre los compuestos. Observa la siguiente ecuación general para representar esta reacción:
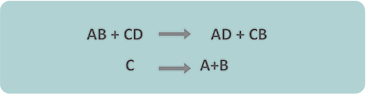
Para que puedas comprender mejor este tipo de reacciones debes tener presente que los compuestos están formados por una parte positiva o catión y una negativa o anión que al reaccionar por doble sustitución se intercambian.

Como habrás podido observar en la imagen, lo que sucede es que A cambió de lugar con C. La diferencia de este tipo de reacción con el desplazamiento es que ni A ni C estaban solos y en ambos casos ninguno de ellos quedó solo luego de la sustitución.
Para entender qué sucede cuando una reacción de este tipo ocurre debes tener en cuenta lo siguiente:
La sustancia AB se halla en solución y de esta forma lo que tenemos en verdad son los iones A+ y B- separados unos de los otros. La sustancia CD también está en solución, por tanto, tenemos también los iones C+ y D- separados.
Cuando se juntan las dos soluciones se promueve una gran mezcla entre los iones A+, B-, C+ y D- , lo que forma una gran sopa de iones.
Si al combinar C+ con B- el compuesto CB fuera soluble los iones serán nuevamente separados en C+ y B- que da como resultado el mismo que teníamos anteriormente. Lo mismo sucede con A+ y B-.
Así, al mezclar AB con CD lo que en realidad se realiza es:
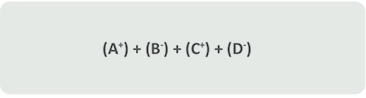
Debes tomar en cuenta que unir iones que se separarán nuevamente resultará en la misma sopa de iones y no en ninguna nueva sustancia, por lo tanto, no ocurre ninguna reacción.
Para que la reacción efectivamente ocurra será necesario que al menos uno de los probables productos (AD o CB) no sea separado al unirse, es decir, deben forma un compuesto insoluble y esto se logra a través de una sal insoluble, de un gas o de agua.
Si uno de los productos fuera una sal insoluble éste no será separado en iones y permanecerá sólido; si fuese un gas se desprenderá de la solución (burbujas) y también permanecerá con sus moléculas agrupadas, y si uno de los productos fuese agua ésta no se desagrega en su propia presencia.
Es característico de este tipo de reacciones:
A) Formación de un precipitado
Esta es la reacción más común de las reacciones de doble sustitución o desplazamiento doble. Para reconocer si se formará un precipitado es importante conocer la solubilidad de las sustancias.
La solubilidad es la máxima cantidad de soluto que se disolverá en una cantidad dada de disolvente a una temperatura específica.
Existen algunas reglas sencillas de solubilidad de los compuestos inorgánicos en agua que se pueden consultar y que permiten predecir la formación de un precipitado.
Los sulfuros (S-2) son insolubles, excepto los de metales alcalinos, alcalinotérreos y el sulfuro de amoniaco.
Los sulfatos (SO4-2) son solubles, excepto el BaSO4, SrSO4 PbSO4; ligeramente solubles el CaSO4 y Ag2SO4
Los cloruros (Cl-) son solubles, excepto el AgCl, HgCl2 y el PbCl2
Los fosfatos (PO4-3) y carbonatos (CO3-2) son insolubles, excepto los de metales alcalinos y las sales de amoniaco
Los óxidos (O-2) y los hidróxidos (OH-) son insolubles, excepto los de metales alcalinos y de ciertos metales alcalinotérreos.
Algunos ejemplos de reacciones de este tipo son:
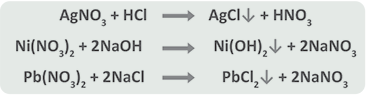
B) Formación de un gas
Son ejemplos de este tipo de reacciones:

C) Desprendimiento de calor
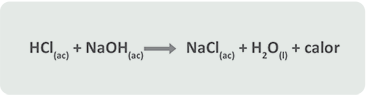
En la reacción anterior participan un ácido y una base o hidróxido, a este tipo de reacciones se les conoce como reacciones de neutralización y como desprenden calor al efectuarse se les consideran reacciones exotérmicas.
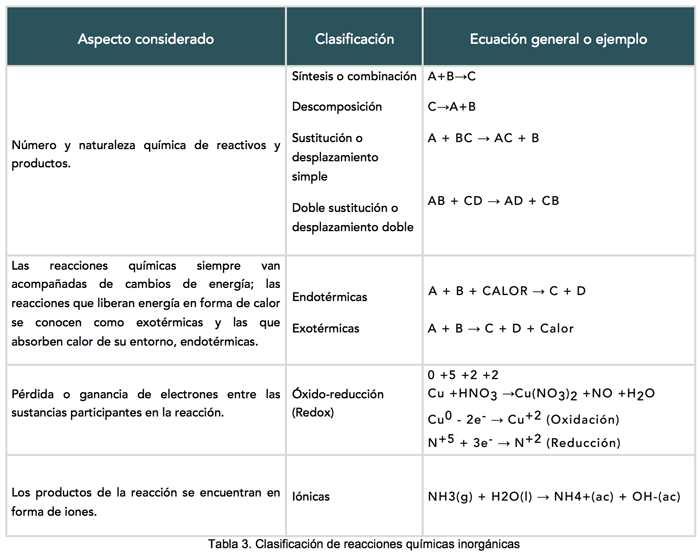
Ahora ya conoces varios tipos de reacciones que se presentan en las combinaciones químicas de las sustancias. Las reacciones se pueden clasificar de otras formas, ello depende del aspecto que se tome en cuenta para su estudio. Los aspectos que se pueden considerar como objeto de estudio en una reacción química se resumen en la siguiente tabla.
Da clic en la lupa y observa la siguiente tabla de la Clasificación de reacciones químicas inorgánicas.
Cómo observaste, una reacción química es todo aquel proceso que se lleva a cabo en la naturaleza, el cual da lugar a la formación de nuevas sustancias, es decir, se refiere a la unión que implica una interacción química entre dos o más sustancias, las cuales pierden sus propiedades individuales, lo que da lugar a la formación de nuevas sustancias y nuevas características donde la interacción puede llevarse a cabo entre compuestos, o bien, entre elementos y compuestos, y puede ser representada mediante un modelo matemático utilizando literales para representar a las sustancias participantes en una reacción química en la que los términos del primer miembro son diferentes químicamente a los del segundo y en una ecuación química se sustituye el signo de igual (=) por una flecha (→) que indica reacción.
Por otro lado, la realidad es que una buena parte del bienestar social conseguido por nuestra sociedad se sustenta en las aportaciones de la química. En la actualidad, los campos de investigación de la química son muy numerosos, fruto de la especialización tanto de procesos como de investigadores, lo cual provoca la aparición de la ingeniería química como respuesta a las necesidades industriales. De entre estos campos, destaca la química de los materiales que desarrolla, entre otros productos, superconductores, cristales líquidos o cerámicas con propiedades que hasta hace poco podían considerarse ciencia ficción y que actualmente contribuyen a mejorar nuestra calidad de vida.
En este capítulo comprendiste la importancia de las reacciones y las ecuaciones químicas, una vez sentadas las bases, en los capítulos subsecuentes comprenderás los Modelos de reacciones químicas, así como el Uso y manejo de las sustancias químicas inorgánicas.