Modelos de reacciones químicas
En esta unidad conocerás los modelos básicos de reacciones químicas, mismos que te permitirán establecer las diferentes sustancias que participan en la obtención de las funciones químicas inorgánicas, así como los elementos que las conforman.
Como recordarás, el manejo de la nomenclatura utilizada en química inorgánica te permite identificar diferentes funciones químicas que se pueden predecir a partir de la construcción de ecuaciones químicas, éstas te posibilitan representar de manera abreviada el proceso de transformación de reactivos a productos, por ejemplo:
El óxido metálico se forma por la reacción entre cualquier metal con moléculas de oxígeno, el cual es diatómico (O2).

Hierro más oxígeno da como producto el óxido férrico.
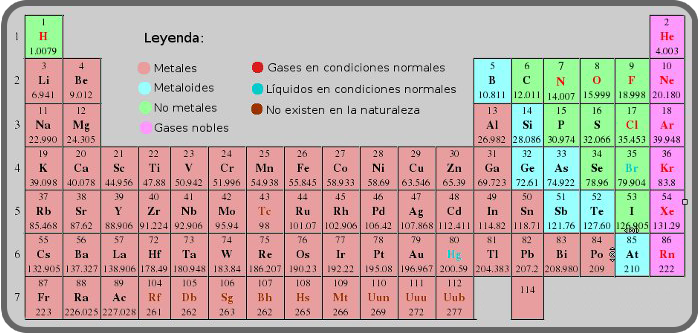
Figura 1. Tabla periódica, localización de metales
Como puedes observar en la tabla periódica, los elementos marcados en rosa son los metales, los cuales puedes combinar para formar los siguientes tipos de reacciones.
Da clic en cada apartado para ver la información.
Metal + Oxígeno ⇒ ⇒ ⇒ Óxido metálico
Enseguida se te presenta un ejemplo acerca de los modelos de reacciones químicas:

Significa que cuatro moléculas de sodio reaccionan con el oxígeno para producir dos moléculas de óxido de sodio. Observa los siguientes ejemplos:
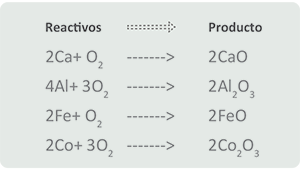
No metal + Oxígeno ⇒ ⇒ ⇒ Óxido no metálico
Los óxidos no metálicos o anhídridos son resultado de la reacción entre un no metal y el oxígeno. Recuerda que algunos de los no metales presentan una gran variabilidad en sus estados de oxidación, como el cloro, elemento que analizarás enseguida:

Producto: monóxido de dicloro.

Producto: trióxido de dicloro.

Producto: pentóxido de dicloro.
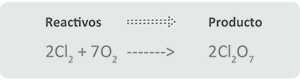
Producto: heptóxido de dicloro.

Metal activo + Agua ⇒ ⇒ ⇒ Hidróxido + H2 
Como recordarás, los metales activos se encuentran ubicados en los grupos IA y IIA, en las familias de los metales alcalinos y alcalinotérreos de la tabla periódica (con la excepción del magnesio), los cuales al contacto con el agua forman un hidróxido, además del desprendimiento de hidrógeno en forma de gas.
Ejemplo:

Productos: 2NaOH (hidróxido de sodio) + H2 (hidrógeno).
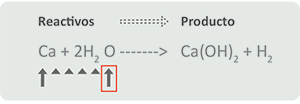
Productos: Ca(OH)2 (hidróxido de calcio) + H2 (hidrógeno).

Productos: 2LiOH (hidróxido de litio) + H2 (hidrógeno).
Óxido metálico + Agua ⇒ ⇒ ⇒ Hidróxido
Otra forma de obtener un hidróxido es mediante la reacción de un óxido metálico con el agua.

Producto: Be(OH)2 (hidróxido de berilio).

Producto: Hg(OH)2 [ hidróxido de mercurio (II) ].
Metal + Hidrógeno ⇒ ⇒ ⇒ Hidruro
Los hidruros son el resultado de la reacción de un metal con el hidrógeno.
Por ejemplo:

Producto resultante: 2KH (Hidruro de potasio).

Producto resultante: BaH2 (Hidruro de bario).

Producto resultante: PbH2 [ Hidruro de plomo (II) ].
No metal + Hidrógeno ⇒ ⇒ ⇒ Hidrácido
Cuando estudiaste las funciones químicas los ácidos contenían a los hidrácidos (terminación hídrica), los cuales se producen al reaccionar un no metal con hidrógeno.
Algunos ejemplos son:

Producto resultante: 2HCl (Ácido clorhídrico).

Producto resultante: PbH2 [Hidruro de plomo (II)].
Óxido no metálico + Agua ⇒ ⇒ ⇒ Oxiácido
Otro tipo de ácidos corresponde a los oxiácidos (terminación -oso e -ico) que se producen al hacer reaccionar un óxido no metálico con agua.
Ejemplos:

Producto resultante: 2HClO4 (Ácido perclórico).

Producto resultante: 2HlO3 (Ácido yódico).

Producto resultante: H2CO3 (Ácido carbónico).
Ácido + Hidróxido ⇒ ⇒ ⇒ Sal + Agua
Esta ecuación también se conoce como de neutralización; se lleva a cabo entre un hidróxido o base y un ácido, la sal obtenida dependerá del tipo de ácido, es decir, si es un hidrácido se conseguirá una sal binaria pero si es un oxiácido será una oxisal.
Por ejemplo:
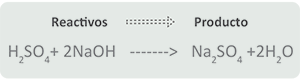
Producto resultante: Na2SO4 (Sulfato de sodio) + 2H2O.
Metal + No metal ⇒ ⇒ ⇒ Sal binaria
Si se hace reaccionar en condiciones adecuadas un metal con un no metal se presenta una reacción que produce sales binarias.
Ejemplo de lo anterior es el caso del litio en una atmósfera de cloro gaseoso donde se produce una reacción exotérmica (desprende calor) que genera un sólido de la sal binaria (cloruro de litio), representada en la siguiente ecuación:

Producto resultante: 2LiCl (Cloruro de litio).
Metal + Ácido ⇒ ⇒ ⇒ Sal + H2
Un ácido reacciona enérgicamente con un metal y genera una sal que dependerá del tipo de ácido y del desprendimiento de hidrógeno.
Por ejemplo:

Producto resultante: 2NaCl (Cloruro de sodio) + H2.


